Neben der Zubereitung von Infusionen, Salben, Pasten etc. werden in Apotheken auch feste orale Arzneiformen (z.B. Tabletten, Kapseln, Dragees) in für die Patienten vorgesehene Behältnisse (z.B. Einnahmebecher, Tages- und Wochendosetten) verteilt (sog. „patientenindividuelles Stellen“) oder auf Vorrat neu verpackt (sog. „Verblisterung“). Das Entblistern, wie auch das Verblistern wird entweder händisch oder automatisiert durchgeführt und muss in einem separaten Raum erfolgen. Von einem separaten Raum kann nur dann abgesehen werden, wenn das Stellen oder manuelle Verblistern nur im Ausnahmefall für einen einzelnen Patienten vorgenommen wird. Der Raum muss von angemessener Größe sein, so dass die einzelnen Arbeitsgänge in spezifisch geordneten Bereichen durchgeführt werden können und Substanzverschleppungen möglichst vermieden werden. Dazu bietet sich eine Unterteilung in folgende Bereiche an:
- ein Bereich für das Ablegen der zu verblisternden Fertigarzneimittel und Verpackungsmaterialien,
- ein Bereich für das Entblistern,
- ein Bereich für die Zwischenlagerung der entblisterten Arzneimittel,
- ggf. ein Bereich für die Zwischenlagerung der angebrochenen Fertigarzneimittelpackungen, die für spätere Blistervorgänge erneut benötigt werden,
- ein Bereich für das Verblistern und Kennzeichnen der verblisterten Arzneimittel.
Außerdem sollten sämtliche Hilfsmittel zur Arzneimittelbereitstellung (Dispenser, Entnahmebecher, Tablettenteiler) sowie Material zur Beseitigung von Kontaminationen im Blisterraum aufbewahrt werden. Die Wände und Oberflächen sowie der Fußboden des Raums müssen leicht zu reinigen sein; Teppichböden und Rauputz sind somit nicht geeignet.
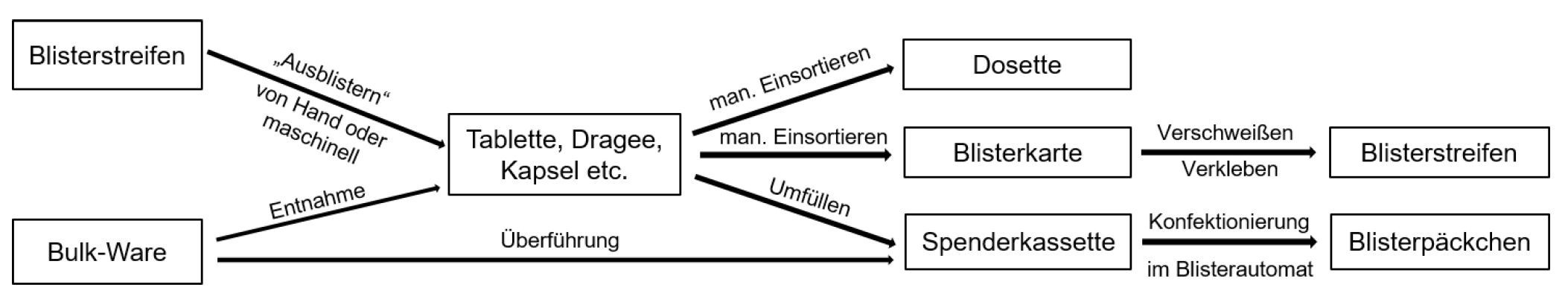 Prozess des Ent- und Verblisterns von festen Oralia
Prozess des Ent- und Verblisterns von festen OraliaBereitstellung von Fertigarzneimitteln zum Entblistern
Ausblistern

Bevor die Fertigarzneimittel manuell oder automatisch verblistert werden können, müssen sie aus ihrer Primärverpackung (z.B. Blister) oder Großverpackungen mit Bulk-Ware (z.B. Dosen mit 150 bis 200 losen Tabletten) entnommen werden. Meistens werden sie aus Blistern unter Zuhilfenahme spezieller Entblisterungsmaschinen oder manuell in einen Auffangbehälter, in das entsprechende Fach der Blisterkarte, in eine Dosette, in eine Spenderkassette (für die Verblisterung im Blisterautomaten, s. Abschnitt „Maschinelles Ent- und Verblistern“, S. 35) oder direkt in die Hand (mit Schutzhandschuhen aus Nitril oder ungepudertem Latex) gedrückt („entblistert“). Je nachdem, ob es sich dabei um überzogene Tabletten und Kapseln oder nicht überzogene Tabletten handelt, können dabei mehr oder weniger große Wirkstoffmengen freigesetzt werden. Dies kann zu einer chronischen Belastung der Beschäftigten führen, wenn die Tätigkeiten wiederholt und ohne die erforderlichen technischen Schutzmaßnahmen (z.B. lokale Absaugung, Arbeiten im Abzug) durchgeführt werden. Das Teilen von Tabletten zum Zwecke der Verblisterung ist nicht zulässig; es sollten stattdessen Fertigarzneimittel mit entsprechender Wirkstoffstärke verwendet werden, soweit diese auf dem Markt verfügbar sind und eine entsprechende Änderung der ärztlichen Verordnung vorliegt. Insbesondere beim Entblistern von atemwegs-sensibilisierenden Arzneimitteln ist darauf zu achten, dass keine wirkstoffhaltigen Stäube in die einatembare Luft gelangen können. Wenn beim Entblistern keine technischen Schutzmaßnahmen zur Absaugung von Stäuben möglich sind, muss den Beschäftigten Atemschutz FFP3 zur Verfügung gestellt werden. Die Benutzung eines einfachen Mundschutzes reicht nicht aus. Es besteht ein Ess- und Trinkverbot. Bei der Überführung der entblisterten Arzneimittel in die dafür vorgesehenen Behältnisse (z.B. Spenderkassetten, Magazine) muss auf eine staubarme Verfahrensweise geachtet werden.
Manuelles Verblistern
Auf die Gefährdungen beim Verblistern von flüssigen Arzneiformen wird an dieser Stelle nicht weiter eingegangen, da dies nur sehr selten stattfindet. Beim manuellen Verblistern von festen Oralia kann es zu hautgefährdenden Tätigkeiten durch den Kontakt mit Arzneistoffen kommen; eine inhalative Belastung ist hierbei weniger zu erwarten, zumal die Verwendung geteilter Tabletten bei der Verblisterung aufgrund des Arzneimittelgesetzes nicht erlaubt ist. Nach vollständiger, manueller Befüllung der Fächer in der Blisterkarte oder der Dosette wird die Tablettenanzahl pro Fach kontrolliert; wenn Korrekturen notwendig sein sollten, empfiehlt es sich, diese mit z.B. einer Pinzette oder einem Löffel vorzunehmen.
Insbesondere beim manuellen Ent- und Verblistern sollten lange Handschuhtragezeiten vermieden werden (z.B. durch Einführung eines Rotationssystems), da dies zu einer Hautgefährdung beitragen kann. Alternativ können Baumwollunterziehhandschuhe dazu eingesetzt werden, um die Feuchtigkeit aufzunehmen. Apothekenpersonal, das ausschließlich mit dem Ent- und Verblistern von Arzneimitteln betraut ist, muss hinsichtlich der richtigen Benutzung der PSA (Handschuhe, ggf. Atemschutz) unterwiesen sein. Ggf. ist eine arbeitsmedizinische Vorsorge erforderlich.
Damit die mit dem Ent- und Verblistern beschäftigten Personen bei einer unbeabsichtigten Freisetzung von Arzneimittelstäuben (z.B. durch zerbrochene Tabletten) zügig angemessene Schutzmaßnahmen ergreifen können, bietet es sich an, die Verpackungen beispielsweise mit einem farbigen Punkt gemäß ABDA-Empfehlung (s. Abschnitt “Lagerung und Kennzeichnung”) zu kennzeichnen. Die Sicherheitsdatenblätter für die in den Arzneimitteln enthaltenen Wirkstoffe liefern die zur Festlegung der Farbe erforderlichen toxikologischen Informationen. Mittelfristig ist hier sicherlich die pharmazeutische Industrie gefordert, die Verpackungen bereits vor Auslieferung mit einer entsprechenden Kennzeichnung zu versehen.
Das manuelle Ent- und Verblistern sollte auf definierten Arbeitsflächen stattfinden, die nach Beendigung der Tätigkeit gemäß Reinigungsplan feucht gereinigt werden sollten. Alle Absaugeinrichtungen müssen die aufgenommenen Arzneimittelstäube sicher zurückhalten und dürfen diese nicht wieder in die Arbeitsumgebung freigeben.
Beim Verlassen des Blisterraums muss die Schutzkleidung abgelegt werden, um eine Verschleppung von Arzneimittelstäuben in andere Räume der Apotheke zu vermeiden.
Das Ent- und Verblistern von Zytostatika, Betäubungsmitteln, Hormonen und Arzneimitteln mit hohem sensibilisierenden Potenzial (z.B. Antibiotika ist generell nicht zulässig, da nicht ausgeschlossen werden kann, dass dabei potenziell gesundheitsschädliche Stäube in die Arbeitsumgebung gelangen und von den Beschäftigten aufgenommen werden. Ist für ein Arzneimittel keine Risikoanalyse möglich, so muss nach dem pharmazeutischen Regelwerk von der Verblisterung abgesehen werden.1
Maschinelles Ent- und Verblistern
Aus Arbeitsschutzsicht sollte technischen Lösungen, wie dem maschinellen Verblistern oder Entblistern mit Luftabsaugung der Vorrang gegeben werden, um die Exposition der Beschäftigten so gering wie möglich zu halten. Trotzdem erfordert auch die tägliche Reinigung verunreinigter Bauteile der Entblisterungsmaschinen (z.B. Gittereinsatz, Medikamentenfach) und Blisterautomaten (z.B. Trichter, Fallrohre, Transportbänder, Spenderkassetten, Tablettenausgang) besondere Schutzmaßnahmen und Vorgehensweisen. Bei der Reinigung der Maschinen bzw. Automaten sollte folgende PSA getragen werden: Schutzhandschuhe, Atemschutz FFP3, Schutzbrille, Schutzkittel. Die Reinigung sollte möglichst in drei Stufen erfolgen: Soweit möglich, sollte das Staubsaugen (Staubsauger muss mit HEPA-Filter ausgestattet sein) mit Reinigungsbürste vor der Nassreinigung und diese wiederum vor der abschließenden Trockenreinigung durchgeführt werden. Auf diese Weise lässt sich eine Freisetzung und Verschleppung von Verunreinigungen beim Säubern weitestgehend ausschließen. Zu schmale oder nur schwer zugängliche Stellen müssen ggf. mit einem Pinsel oder einer Bürste gereinigt werden.
Damit auch für die Beschäftigten in den zu versorgenden Einrichtungen (z.B. Krankenhäuser, Arztpraxen, Pflegedienste, Werkstätten für behinderte Menschen) sofort erkennbar ist, dass bei der Entnahme und Gabe der Arzneimittel möglicherweise eine Gesundheitsgefährdung für sie entstehen kann, wäre es sinnvoll, die Blisterpäckchen entsprechend zu kennzeichnen. Die Risikokommunikation könnte beispielsweise durch einen Farbpunkt gemäß ABDA-Empfehlung (s. Abschnitt “Lagerung und Kennzeichnung”) erfolgen, wobei dies sicherlich bei Unit-dose- Blisterpäckchen (enthalten eine Dosis eines bestimmten Arzneimittels) leichter umsetzbar sein dürfte, als bei Multi-Dose-Blisterpäckchen (enthalten mehrere der zu einem bestimmten Zeitpunkt einzunehmenden Arzneimittel). Da Unit-Dose- Blister eher in der stationären als in der ambulanten Arzneimittelversorgung angewendet werden, wäre die Farbkennzeichnung insbesondere bei der Belieferung von Krankenhäusern hilfreich.
1Bundesapothekerkammer BAK (Hrsg.): Kommentar zur Leitlinie der Bundesapothekerkammer zur Qualitätssicherung. Patientenindividuelle manuelle Neuverpackung von Fertigarzneimitteln für bestimmte Einnahmezeitpunkte. (Stand: 13.06.17 [online]) und Aide-mémoire 07120201 „Maschinelles patientenindividuelles Verblistern von Arzneimitteln“, ZLG.
Der hier verwendete Text wurde aus der Informations- und Handlungshilfe „Arzneimittel im Gesundheitsdienst und der Wohlfahrtspflege“ entnommen.
